Dalton: El càlcul dels pesos atòmics
Aquest fragment procedeix de l’obra de John Dalton, A New System of Chemical Philosophy, London, 1808. vol. I, part I, cap. III, p. 211-216
En totes les investigacions químiques, el coneixement dels pesos relatius dels [elements] simples que constitueixen un compost ha estat considerat amb seny un tema de gran importància. No obstant això, per desgràcia, la indagació ha acabat aquí, malgrat que podria haver-se deduït dels pesos relatius en massa, els pesos relatiu de les últimes partícules o àtoms dels cossos, i a partir d’aquesta informació el seu número i pes en altres compostos sortiria a la llum, la qual cosa permetria assistir i orientar les recerques futures i corregir els seus resultats. Es doncs un objectiu important d’aquest treball mostrar la importància i els avantatges d’esbrinar els pesos relatius de les últimes partícules, tant de cossos simples com compostos, el nombre de partícules simples elementals que constitueix una partícula composta, i el nombre de partícules menys compostes que entren en la formació d’una partícula més composta.
Si existeixen dos cossos, A i B, amb capacitat de combinar-se, heus aquí l’ordre en el qual les combinacions podrien tenir lloc, començant per la més simple:
1 àtom de A + 1 àtom de B = 1 àtom de C, binari
1 àtom de A + 2 àtoms de B = 1 àtom de D, ternari
2 àtoms de A + 1 àtom de B = 1 àtom de E, ternari
1 àtom de A + 3 àtoms de B = 1 àtom de F, quaternari
3 àtoms de A + 1 àtom de B = 1 àtom de G, quaternari, etc.
Les següents regles generals poden ser adoptades com a guies en totes les nostres recerques respecte a la síntesi química:
1.- Quan només una combinació entre dos cossos pot ser obtinguda, ha de suposar-se que és una combinació binària, tret que alguna raó indiqui el contrari.
2.- Quan es coneixen dues combinacions, ha de suposar-se que una és binària i una altra ternària.
3.- Quan s’obtenen tres combinacions, podem esperar que una és binària i les altres dues ternàries.
4.- Quan es coneixen quatre combinacions, hem d’esperar que una és binària, una altra ternària, i una altra quaternària, etc.
5.- Un compost binari ha de ser sempre explícitament més pesat que la simple mescla dels seus dos components.
6.- Un compost ternari ha de ser explícitament més pesat que la mescla d’un binari i un simple que, en combinar-se, ho constitueixen, etc.
7.- Les anteriors regles s’apliquen igualment quan dos cossos com a C i D, D i E, etc., es combinen.
De l’aplicació d’aquestes regles a fets químics ja ben establerts, podem obtenir les següents conclusions:
1.- Que l’aigua és un compost binari d’hidrogen i d’oxigen, i que els pesos relatius d’aquests dos àtoms elementals són aproximadament com 1:7
2.- Que l’amoníac és un compost binari d’hidrogen i azot, i que els pesos relatius dels dos àtoms són aproximadament com 1:5
3.- Que el gas nitrós és un compost binari d’azot i d’oxigen, els àtoms del qual pesen respectivament 5 i 7; que l’àcid nítric és un compost binari o ternari, segons la seva fabricació, i que consisteix en un àtom d’azot i dos d’oxigen, que pesen conjuntament 19; que l’òxid nitrós és un compost similar a l’àcid nítric, i que està format d’un àtom d’oxigen i de dos d’azot, pesant en total 17; que l‘àcid nitrós és un compost binari d’àcid nítric i de gas nitrós, pesant 31; que l’àcid oxinítric és un compost binari d’àcid nítric i d’oxigen, pesant 26;
4.- Que l’òxid carbònic és un compost binari, format d’un àtom de carbó i un àtom d’oxigen, que pesen en conjunt 12; que l’àcid carbònic és un compost ternari (encara que a vegades binari) format d’un àtom de carbó, i de dos d’oxigen, que pesen en total 19; etc.
En tots els casos, els pesos han estat expressats en àtoms d’hidrogen, cadascun d’ells denotat per la unitat.
Taula amb els símbols dels àtoms
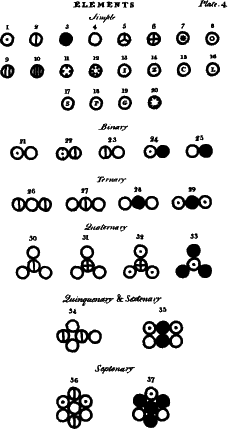
1.- Hidrogen, el seu pes relatiu 1
2.- Nitrogen, 5
3.- Carboni, 5
4.- Oxigen, 7
5.- Fòsfor, 9
6.- Sofre, 13
7.- Magnèsia, 20
8.- Calç, 23
9.- Soda, 28
10.- Potassa, 42
Més informació:
Pellón González I.; Rocke, A.; García Belmar, A. El atomismo en química. Un Nuevo Sistema de Filosofía Química de John Dalton. Alicante: Publicaciones de la Universidad de Alicante; 2012.
